Les protéines sont indispensables aux nombreux processus qui gouvernent la vie de la cellule. Elles agissent le plus souvent au sein de complexes mutliprotéiques où leurs actions sont régulées à travers des réseaux d’interaction protéine-protéine. Elles constituent ainsi un ensemble de molécules dont le comportement social est essentiel à l’organisation du vivant. Les chaperons moléculaires sont des acteurs clés du contrôle de l’assemblage de ces complexes macromoléculaires. Parmi ces chaperons, la protéine Hsp90 a été initialement trouvée associée à des protéines de la signalisation cellulaire, comme les récepteurs nucléaires aux stéroïdes et les tyrosine kinases. Plus récemment, elle a été impliquée dans l’assemblage de nombreuses machines moléculaires telles que les RNA polymérases, les ribonucléoprotéines (RNPs) dont la télomérase, ou les protéines kinases apparentées à la phosphatidylinositol 3-kinase (PIKKs) comme mTOR. Ces protéines, toutes dépendantes du chaperon moléculaire Hsp90 pour leur maturation ou leur assemblage, sont appelées protéines clientes d’Hsp90. Beaucoup d’entre elles contrôlent des fonctions impliquées dans la transformation maligne comme la prolifération cellulaire, l’immortalisation, l’angiogenèse ou l’apoptose. Or l’inhibition spécifique d’Hsp90 provoque la dégradation de ces clientes oncogéniques par le protéasome. Hsp90 est ainsi devenu une cible anticancéreuse rationnelle qui permet de s’attaquer simultanément aux principales signatures caractéristiques du cancer (Cancer hallmarks). A ce titre elle a suscité un intérêt sans précédent.
Pour autant, alors que l’étude du mode d’action de nombreux chaperons moléculaires a beaucoup progressé ces dernières années, celui d’Hsp90 reste encore très mal compris. La maturation des protéines clientes par Hsp90 est un phénomène ATP dépendant. Il est couplé à la fixation puis à l’hydrolyse du nucléotide par le chaperon. Hsp90 se comporte ainsi comme une pince moléculaire. La régulation de son cycle ATPase met en jeu un ensemble de protéines partenaires, appelées cochaperons, qui font d’Hsp90 un système d’une grande complexité (figure). Notre équipe cherche à élucider les mécanismes moléculaires de cette véritable machinerie chaperon à la base de son action sur les protéines clientes. Nous souhaitons en particulier comprendre le rôle des cochaperons dans les mécanismes de reconnaissance et d’assemblage des clientes, ainsi que les bases moléculaires du couplage entre activité ATPase, changements conformationnels associés et activation des clientes. Pour cela, nous utilisons une approche structurale mêlant la cristallographie des protéines aux études fonctionnelles avec les outils de la biochimie, de la biophysique ainsi que de la biologie moléculaire chez le modèle levure Saccharomyces cerevisiae.
Ce projet permettra une compréhension en profondeur, à l’échelle atomique, des mécanismes à l’œuvre lors de l’assemblage de complexes multi-protéiques clients par Hsp90. Etant donné l’importance du chaperon et de ses clients dans de nombreuses maladies dont le cancer, les structures tridimensionnelles que nous proposons de résoudre devraient avoir des retombées importantes pour le développement de nouvelles approches thérapeutiques et la conception rationnelle de nouveaux inhibiteurs d’Hsp90 constitue un de nos principaux objectifs.
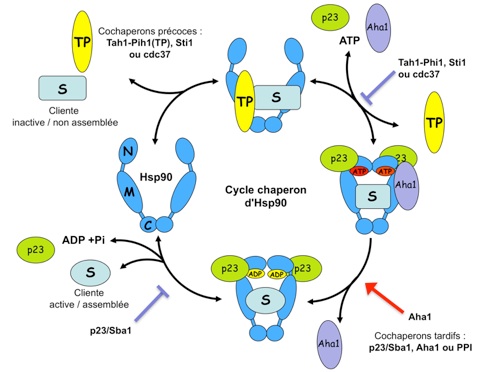
Le cycle chaperon de Hsp90. Hsp90 est une protéine dimérique composée de trois domaines (N, M et C). Elle forme une pince moléculaire dont la conformation est gouvernée par la fixation et l’hydrolyse de l’ATP. Hsp90 ouverte est associée aux cochaperons précoces Tah1-Pih1, Hop/Sti1 ou cdc37, qui permettent le chargement des protéines clientes. La conformation fermée d’Hsp90 liée à l’ATP est elle associée aux cochaperons tardifs p23/Sba1 ou Aha1, qui contrôlent l’activité ATPase et la libération des protéines clientes.
Financements:






