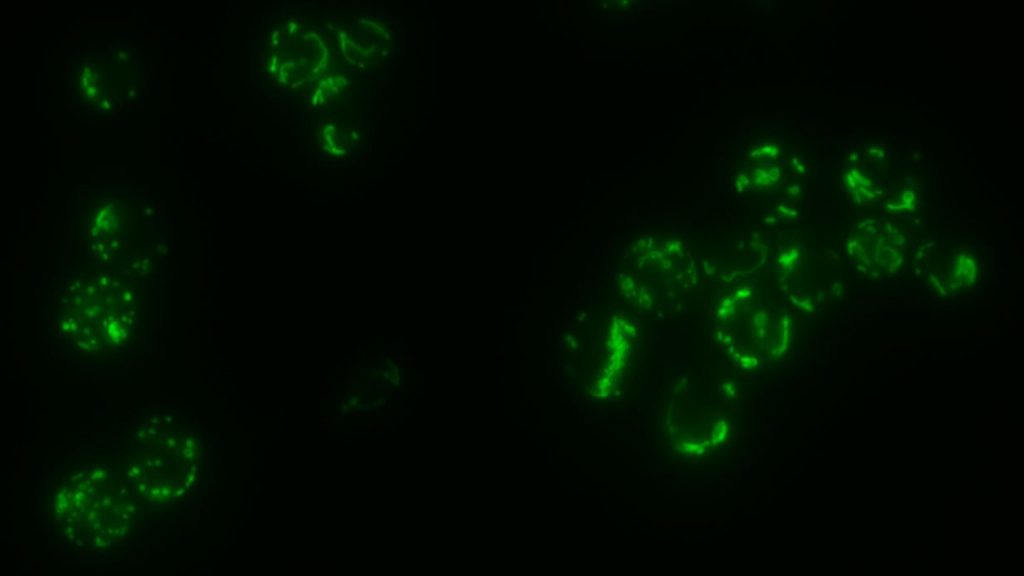
La fusion des membranes biologiques constitue le système par lequel la communication entre les différents organites des cellules eucaryotes s’opère. Elle s’effectue selon trois étapes distinctes qui incluent le mouvement, l’ancrage puis la fusion entre les compartiments cellulaires. Cette dernière étape est en général assurée par des protéines à domaines ‘coil-coiled’ appelées SNAREs excepté en ce qui concerne les peroxysomes et les mitochondries. Les mitochondries ne sont pas des organites isolés les uns des autres mais constituent un véritable réseau cellulaire comparable au réticulum endoplasmique ou à l’appareil de Golgi. Dans des cellules sauvages, ce réseau adopte une morphologie tubulaire qui est conditionnée par un équilibre constant entre des processus actifs de fission et de fusion des membranes mitochondriales.
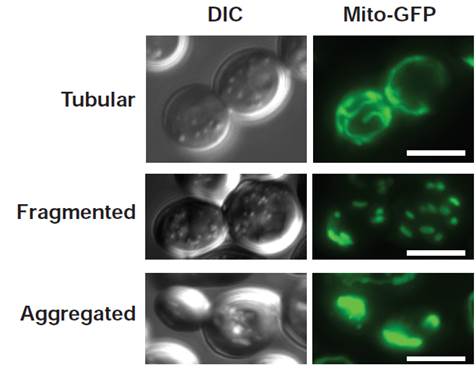
La fusion mitochondriale fait appel à un mécanisme remarquablement conservé de la levure jusqu’à l’homme. Ce système ne met pas en jeu des SNAREs, mais deux types de GTPases, les mitofusines et OPA1/Mgm1, respectivement impliquées dans la fusion de la membrane externe puis celle de la membrane interne. De ce fait, ces GTPases participent non seulement à la transmission de l’ADN mitochondrial et donc a la phosphorylation oxydative mais jouent aussi un rôle majeur dans l’apoptose. En outre, l’inhibition de la fusion mitochondriale est directement liée à plusieurs syndromes neurodégénératifs parmi lesquels la maladie de Charcot-Marie Tooth, la maladie de Parkinson ou encore l’atrophie optique dominante. Enfin, l’étendue des similitudes entre la fusion mitochondriale et la fusion catalysée par les SNAREs fait l’objet de toutes les attentions. Ainsi, la nécessité d’élucider les mécanismes moléculaires qui régissent la fusion des membranes mitochondriales apparaît primordiale.
Alors que l’étude de la fusion mitochondriale a considérablement progressé au cours des dix dernières années, plusieurs questions restent en suspens. Comment les mitochondries se rapprochent les unes des autres ? Quelles sont les étapes mécanistiques qui permettent leur ancrage ? Comment la fusion des membranes externe et interne est-elle coordonnée ? Notre projet va aborder ces questions passionnantes dans le contexte de la levure Saccharomyces cerevisiae où nous avons mis en évidence que Fzo1, la mitofusine de levure, est modifiée de façon covalente par une protéine de 76 acides aminés : l’ubiquitine. Nous nous attacherons à disséquer le rôle de cette modification post-traductionnelle dans les différentes étapes du processus de fusion mitochondriale.

Financements :